49ο ΓΕΝΙΚΟ ΛΥΚΕΙΟ ΑΘΗΝΩΝ
ΤΟ ΝΕΡΟ ΩΣ ΧΗΜΙΚΟ ΜΟΡΙΟ, ΟΙ ΤΡΕΙΣ ΦΑΣΕΙΣ ΤΟΥ, ΟΙ ΦΥΣΙΚΟΧΗΜΙΚΕΣ ΤΟΥ ΙΔΙΟΤΗΤΕΣ
ΧΗΜΙΚΟ ΜΟΡΙΟ Το μόριο του νερού αποτελείται από δύο άτομα υδρογόνου (Η) και ένα άτομο οξυγόνου (Ο), που συνδέονται μεταξύ τους με ομοιοπολικούς δεσμούς.
Έχει χημικό τύπο H2O, αλλά σε μερικές περιπτώσεις χρησιμοποιείται και ο τύπος, ΗΟΗ και σπανιότερα ΟΗ2. Η σχετική αναλογία μαζών του υδρογόνου και του οξυγόνου είναι 2,016:16,000, δηλαδή περίπου 1:8.
Δεσμοί Η στο νερό
Το
μόριο του νερού δεν είναι γραμμικό, δηλαδή οι δεσμοί Ο-Η δε βρίσκονται πάνω στην
ίδια ευθεία, αλλά σχηματίζουν γωνία 104,5°. Λόγω της γωνιακής διάταξης του
δεσμού Ο-Η, το μόριο του νερού είναι ασύμμετρο και έχει υψηλή διπολική
ροπή. Το κέντρο του θετικού φορτίου βρίσκεται
προς την πλευρά του υδρογόνου και του αρνητικού προς την πλευρά του οξυγόνου. Ο
υψηλός πολικός χαρακτήρας του μορίου εξηγεί τη μεγάλη του διηλεκτρική
σταθερά (78 στους 25°C) και άλλες
ιδιότητες αυτού, όπως είναι η διάλυση ιοντικών ενώσεων, ιδιότητα που το καθιστά
το καλύτερο διαλυτικό μέσο.
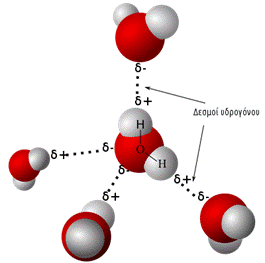
Το νερό παρουσιάζει έντονα το φαινόμενο της σύζευξης, με τη
δημιουργία μεταξύ των μορίων του δεσμών
υδρογόνου. Τα μόρια δηλαδή του νερού σχηματίζουν γέφυρες μεταξύ του
ηλεκτροθετικού υδρογόνου ενός μορίου και του ηλεκτραρνητικού οξυγόνου άλλου
μορίου.
Δεσμοί υδρογόνου μεταξύ των μορίων του νερού εξακολουθούν
να υπάρχουν και σε υψηλή σχετικά θερμοκρασία, όπως το μόλις λιωμένο νερό στο
οποίο έχουν σπάσει το 15 % των δεσμών υδρογόνου.
ΟΙ ΤΡΕΙΣ ΦΑΣΕΙΣ
TOY
ΝΕΡΟΥ:
Όπως πολλές ουσίες, το νερό μπορεί να πάρει μέρος σε πολλές μορφές που γενικά
χαρακτηρίζονται από την κατάσταση της ύλης στην οποία βρίσκονται. Η υγρή φάση
είναι η πιο συνηθισμένη του νερού στη Γη (βασικά στην επιφάνεια και στην
ατμόσφαιρα). Ουσιαστικά αυτή είναι η κατάσταση που εννοεί στην καθομιλουμένη η
λέξη «νερό».
Η στερεή φάση του νερού είναι γνωστή ως «πάγος» και συνήθως
παίρνει τη δομή σκληρών αμαγαλματικών κρυστάλλων, όπως οι κύβοι πάγου, ή χαλαρά
συνδεδεμένων εύθραυστων κρυστάλλων, όπως στο χιόνι.
Η αέρια
φάση του νερού είναι γνωστή ως «υδρατμός» και προϋποθέτει τη δομή ενός διαφανούς
νέφους. Στα νέφη, το νερό βρίσκεται στη μορφή υγρών σταγονιδίων ή και στερεών
κρυστάλλωνπου αιωρούνται στον αέρα
Η τέταρτη κατάσταση στην οποία είναι δυνατό να βρεθεί το νερό, αν και σπανίως
αφού δεν ανήκει στις κοινές φάσεις, είναι αυτή του υπερκρίσιμου
υγρού. Αυτό συμβαίνει όταν το νερό πετύχει να βρίσκεται ταυτόχρονα στην (ή και
σε θερμοκρασία πάνω από την) κρίσιμη
θερμοκρασία του (647 Κ) και υπό την
(ή υπό πίεση μεγαλύτερη από την) κρίσιμη
πίεσή του (22,064 MPa). Σε αυτές τις
συνθήκες η υγρή και αέρια φάση συνενώνονται σε μια ομογενή ρευστή φάση που
διαθέτει ταυτόχρονα ιδιότητες που αντιστοιχούν σε αέρια και υγρά. Ένα παράδειγμα
τέτοιας κατάστασης για το νερό στη φύση είναι τα θερμότερα στρώματα νερού σε
μεγάλα βάθη, κοντά σε υποθαλάσσια ρεύματα, υδροθερμικές πηγές ή ενεργά ηφαίστεια.
Γενικά οπουδήποτε υπάρχει νερό σε
θερμοκρασία ίση ή μεγαλύτερη από 647 Κ και βάθος ίσο ή μεγαλύτερο από 2.250 m,
βρίσκεται στην κατάσταση υπερκρίσιμου υγρού. Το νερό επίσης υπάρχει και στην
κατάσταση υγρού
κρυστάλλου, κοντά σε υδρόφιλες επιφάνειες άλλων ουσιών.
OI
ΦΥΣΙΚΕΣ ΙΔΙΟΤΗΤΕΣ TOY
ΝΕΡΟΥ: Το νερό είναι υγρό,
διαυγές, άχρωμο σε λεπτά στρώματα, κυανίζον σε μεγάλους όγκους. Η καθαρή ουσία
είναι άγευστη, ενώ το καλό πόσιμο νερό έχει ευχάριστη
γεύση, που οφείλεται στα διαλυμένα άλατα και
αέρια.
Η πυκνότητα του
νερού είναι διαφορετική σε διάφορες θερμοκρασίες,
με μέγιστη στους 4 ° C.

Ο όγκος μιας συγκεκριμένης ποσότητας νερού αυξάνεται κατά την ψύξη, γιατί η μοριακή δομή του πάγου στηρίζεται στους δεσμούς υδρογόνου, οι οποίοι συγκρατούν τα μόρια σε θέσεις με αρκετά κενά μεταξύ τους. Αυτό έχει μεγάλη σημασία για τη ζωή στον πλανήτη μας: Οι πάγοι επιπλέουν στο νερό και δρουν ως μονωτικά, εμποδίζοντας το νερό που βρίσκεται από κάτω να παγώσει, με όλες τις ευεργετικές συνέπειες στη ζωή του υδρόβιου κόσμου.


Αστερίες κάτω από πάγους
Χωρίς την "ανωμαλία" αυτή της πυκνότητας του νερού, η ζωή στον πλανήτη μας δε θα
υπήρχε, τουλάχιστον με τη σημερινή της μορφή, εξαιτίας της βαθμιαίας ψύξης του
νερού της επιφάνειας της Γης.
Η ιδιορρυθμία της πυκνότητας του νερού είναι επίσης και η αιτία
της αποσάθρωσης των βράχων. Το νερό που εισέρχεται στις ρωγμές των βράχων
στερεοποιείται κατά τη διάρκεια του χειμώνα και προκαλεί την αποσάθρωσή τους.
Ακόμα, το σπάσιμο των σωλήνων διανομής του νερού κατά το χειμώνα οφείλεται στην
αύξηση του όγκου του νερού κατά τη μετάβαση από την υγρή στη στερεή κατάσταση.
Τέλος, η συμπεριφορά αυτή του νερού εξηγεί γιατί τα
παγοπέδιλα γλιστρούν επάνω στον πάγο. Η πίεση, η οποία ασκείται στον πάγο, τον
αναγκάζει να λιώσει , έστω και αν η θερμοκρασία του είναι αρκετά κάτω από 0οC,
οπότε σχηματίζεται λεπτό στρώμα νερού, που δρα ως λιπαντικό και μειώνει την
τριβή. Όταν το παγοπέδιλο πάψει να εφάπτεται με τον πάγο, το νερό που βρίσκεται
στο σημείο εκείνο έχει θερμοκρασία χαμηλότερη των 0οC
και για αυτό στερεοποιείται και πάλι.

Το
ίδιο συμβαίνει και με τα σκι που γλιστρούν στο χιόνι
Η ανωμαλία αυτή διαρκεί μέχρι τους 4 °C περίπου και έπειτα, η συμπεριφορά είναι
η γνωστή, όταν η θερμοκρασία αυξάνεται, αυξάνεται και ο όγκος.
Το νερό έχει πολύ μεγάλη ειδική
θερμότητα (4200J/Kg.°C)
(θερμοχωρητικότητα), 1 cal.g−1.°C−1 και
γι’ αυτό χρησιμοποιείται ευρύτατα ως ψυκτικό μέσο και ως φορέας θερμότητας στα
καλοριφέρ.
Το νερό έχει τη μεγαλύτερη θερμοχωρητικότητα από όλα τα
στερεά και τα υγρά με εξαίρεση την αμμωνία. Αποθηκεύει μεγάλα ποσά θερμότητας
που μεταφέρονται με τα θαλάσσια ρεύματα και επηρεάζει το κλίμα των περιοχών.
Μετριάζει τις ακραίες θερμικές καταστάσεις στις παράκτιες περιοχές και συμβάλλει
στο παγκόσμιο κλίμα δημιουργώντας τάσεις ομοιόμορφης κατανομής της θερμοκρασίας.
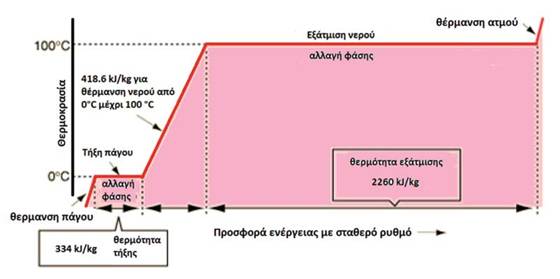
Το νερό έχει τη μεγαλύτερη λανθάνουσα θερμότητα
εξάτμισης-συμπύκνωσης από όλες τις φυσικές ενώσεις. Είναι η θερμότητα που πρέπει
να προστεθεί σε 1g
νερού για να μεταβεί από την υγρή στην αέρια φάση. Η θερμική αυτή ποσότητα είναι
μεγάλη, γιατί πρέπει να σπάσουν όλοι οι δεσμοί υδρογόνου, πριν το νερό μεταβεί
στην αέρια φάση και είναι 540
cal/g
στους 100οC
. Στην θάλασσα όμως, η εξάτμιση συμβαίνει σε πολύ χαμηλότερη θερμοκρασία (π.χ.
20οC).
Τότε τα μόρια που εξατμίζονται, αντλούν το ποσό της θερμότητας που χρειάζονται
από τα γειτονικά τους μόρια, που είναι ακόμα σε υγρή φάση, προκαλώντας ψύξη.
Στις θερμοκρασίες όμως αυτές, απαιτούνται 585cal/g
γιατί πρέπει να σπάσουν περισσότεροι δεσμοί υδρογόνου από ότι στους 100οC.
Με τον τρόπο αυτό η εξάτμιση, από τα χαμηλά γεωγραφικά πλάτη, αφαιρεί τη
θερμότητα που είχε συσσωρευτεί από την έντονη ηλιακή ακτινοβολία. Όταν γίνει
συμπύκνωση και υγροποίηση αυτών των υδρατμών, σε μεγαλύτερα γεωγραφικά πλάτη, η
λανθάνουσα θερμότητα αποδίδεται στο περιβάλλον. Η απότομη απόδοση στο περιβάλλον
της θερμότητας, προξενεί αναταραχή στην ατμόσφαιρα, με αποτέλεσμα να
δημιουργούνται θύελλες και τυφώνες. Έτσι τεράστια ποσά θερμότητας μεταφέρονται
από τον ισημερινό σε μεγαλύτερα γεωγραφικά πλάτη.

Ο τυφώνας Andrew
Η λανθάνουσα θερμότητα τήξης, είναι η ποσότητα θερμότητας που
πρέπει να προστεθεί στον πάγο, για να σπάσουν όσοι δεσμοί χρειάζεται ώστε αυτός
να μεταπέσει στην υγρή φάση. Η ποσότητα αυτή (80
cal/g),
είναι μικρότερη από την αντίστοιχη της εξάτμισης, γιατί σημαντικός αριθμός
δεσμών υδρογόνου διατηρείται στο νερό των χαμηλών θερμοκρασιών. Πρακτική
εφαρμογή αποτελούν τα παγόβουνα τα οποία εισέρχονται στην ωκεάνια κυκλοφορία και
απορροφούν μεγάλα ποσά θερμότητας από τους ωκεανούς ώσπου να λιώσουν.
Το νερό έχει τη μεγαλύτερη επιφανειακή τάση από όλα τα υγρά. Έχει
σημασία στο σχηματισμό σταγόνων, στη δημιουργία των κυμάτων αλλά έχει επίσης και
μεγάλη βιολογική σημασία γιατί ελέγχει την φυσιολογία των κυττάρων.
Το νερό διαλύει τις περισσότερες ενώσεις και σε μεγαλύτερη ποσότητα
από οποιοδήποτε άλλο υγρό. Αυτό γίνεται δυνατό λόγω της μοριακής πολικότητας του
με τη δημιουργία ιοντικών δεσμών. Οι ουσίες που διαλύονται, διασπώνται σε θετικά
φορτισμένα ανιόντα και αρνητικά φορτισμένα κατιόντα. Τότε τα μεν ανιόντα
περιβάλλονται με τα μόρια νερού τα οποία έχουν προσκολληθεί με τα άτομα του
οξυγόνου (αρνητικά φορτισμένου), τα δε κατιόντα περιβάλλονται επίσης με μόρια
νερού τα οποία έχουν προσκολληθεί με τα άτομα του υδρογόνου (θετικά φορτισμένα).
Είναι προφανής η σημασία της μεγάλης διαλυτικής ικανότητας του νερού τόσο στον
ανόργανο όσο και στον οργανικό κόσμο.
Διηλεκτρική σταθερά
Η διηλεκτρική σταθερά του νερού είναι η υψηλότερη όλων των υγρών και έχει μεγάλη σημασία για τη συμπεριφορά των ανόργανων διαλυμένων ενώσεων λόγω της υψηλής διάστασης που υπάρχει.
Ιξώδες
Το νερό έχει μικρότερο ιξώδες από τα περισσότερα υγρά, αυτό διευκολύνει τόσο τη ροή του επάνω και μέσα στη χέρσο, όσο και στη μετακίνηση θαλάσσιων μαζών στον ωκεανό για την εξισορρόπηση διαφορών πίεσης, δημιουργώντας έτσι τα θαλάσσια ρεύματα.


Τον διάσημο πίνακα του Βίνσεντ
Βαν Γκογκ ” Έναστρη Νύχτα” του
1889, θυμίζει η οπτικοποίηση των κυκλικών ρευμάτων των ωκεανών της Γης, όπως τα
κατέγραψε η NASA
ΟΙ ΧΗΜΙΚΕΣ ΙΔΙΟΤΗΤΕΣ
ΤΟΥ ΝΕΡΟΥ:
Το νερό έχει ποικίλη
χημική δράση. Σχηματίζει "ενώσεις διά προσθήκης" με πολλά άλατα, καθώς και με
πολλά μόρια άλλων ουσιών. Οι ενώσεις αυτές ονομάζονται υδρίτες ή ένυδρες
ενώσεις.
Οι δυνάμεις που ενώνουν τα μόρια των ουσιών και του νερού
είναι:
Ελκτικές δυνάμεις μεταξύ του θετικού ιόντος του μετάλλου και του αρνητικού οξυγόνου του πολωμένου μορίου του νερού
Σχηματισμός ημιπολικού δεσμού μεταξύ του ατόμου του οξυγόνου και του ιόντος του μετάλλου με ένα ζεύγος ηλεκτρονίων.
Σχηματισμός γέφυρας υδρογόνου μεταξύ του μορίου του νερού και της
ουσίας.
Άλλος σημαντικός τύπος αντίδρασης του νερού είναι η υδρόλυση (διάσπαση ενώσεων
με τη βοήθεια νερού).
Το νερό επιτελεί αντιδράσεις οξειδοαναγωγής, όπου δρα άλλοτε ως οξειδωτικό και άλλοτε ως αναγωγικό μέσο.